Sul blog si enuncia la prima legge di Lavoisier, universalmente riconosciuto come il “padre della chimica”, sulla conservazione della massa che in parole povere dice che nel corso di una reazione chimica la materia non si crea, non si distrugge ma si trasforma.
Questo articolo non vuole dare lezioni di chimica né tantomeno farvi strabuzzare gli occhi dalle orbite analizzando complesse formule chimiche, bensì vuole definire la reazione chimica facendo alcuni esempi pratici ed infine mettere in pratica quanto detto tramite l’esecuzione di un esperimento.
In una reazione chimica si distinguono i reagenti che ha seguito della reazione si trasformano in prodotti. I reagenti, detti anche specie chimiche, interagiscono tra di loro creando prodotti (altre specie chimiche) differenti da quelli che inizialmente hanno dato luogo alla reazione chimica.
Durante la reazione si ha la formazione o la rottura di legami chimici intramolecolari.
Ecco alcune delle più semplici reazioni chimiche:
- Il ferro che a seguito della corrosione si trasforma in ruggine (ossido di ferro);
- combustione del metano;
- la digestione durante la quale gli alimenti sono decomposti dai succhi gastrici in sostanze chimiche assimilabili dall’organismo.
In una reazione chimica possono essere coinvolte anche altre due specie chimiche chiamate inerti e catalizzatori. I primi non prendono parte né modificano il meccanismo della reazione, mentre i secondi pur non partecipando alla reazione ne modificano la velocità alla quale la reazione avviene.
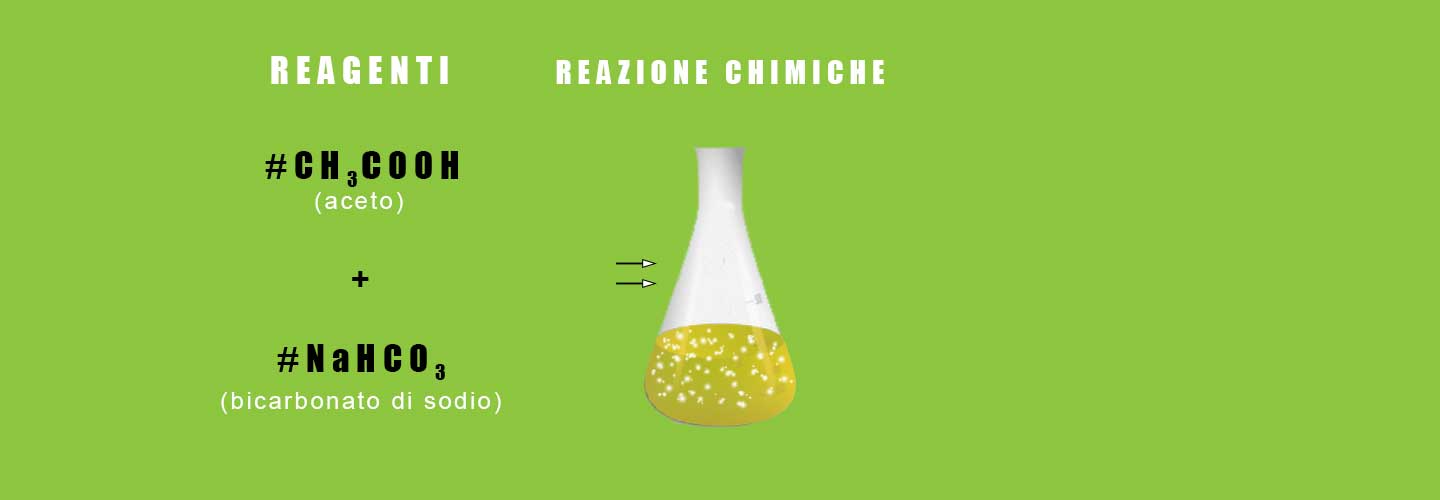
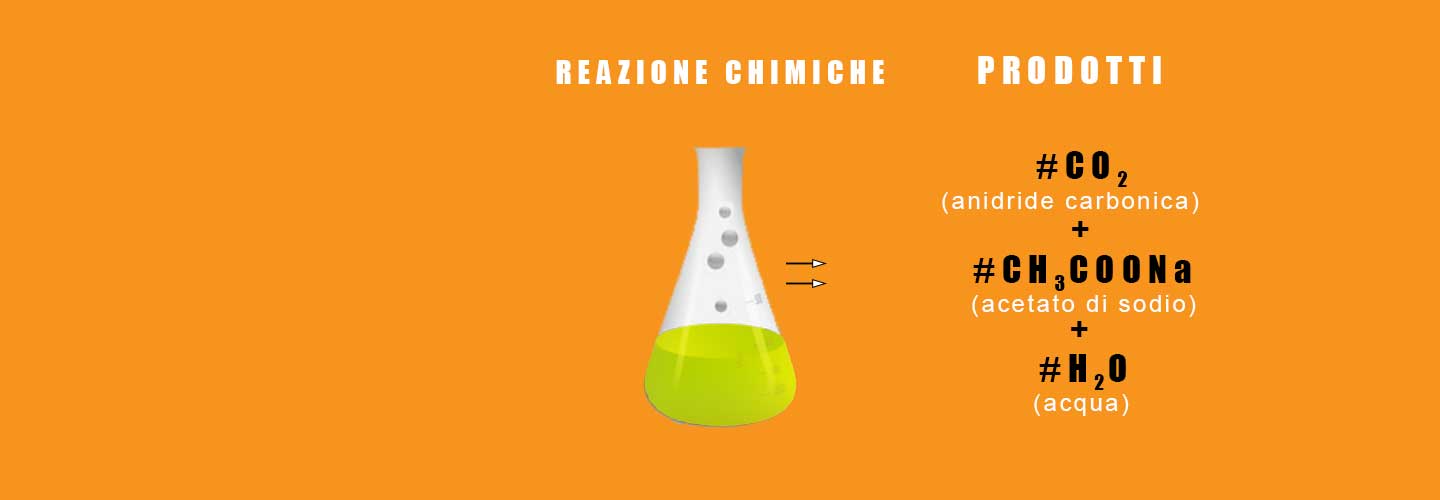
Analizzeremo in dettaglio, forse, la reazione chimica di cui avete più volte sentito parlare. I nostri reagenti saranno un acido ed una base nel caso specifico l’acido sarà l’aceto di vino e la base sarà il bicarbonato di sodio. Da questa reazione si ottengono rispettivamente i prodotti che sono l’anidride carconica (CO2), acetato di sodio (CH3COONa) e acqua (H2O).
Ecco i reagenti (a sinistra della freccia) e i prodotti (a destra della freccia) scritti con la loro formula chimica
| aceto | + | bicarbonato di sodio | -> | anidride carbonica | + | acetato di sodio | + | acqua |
| CH3COOH | + | NaHCO3 | -> | CO2 | + | CH3COONa | + | H2O |
Per l’esperimento servono i seguenti materiali:
- Un contenitore di forma cilindrica (es. una bottiglia);
- un palloncino;
- una spatola.
Ecco come si procede per ottenere la reazione:
- Versare 20 cl. di aceto nel contenitore (se ne utilizate uno graduato vi verrà più semplice, altrimenti potete usare una caraffa graduata per misurare 20 cl. di aceto);
- inserire nel palloncino il bicarbonato con l’uso della spatola (quattro dosi di una piccola spatola);
- inserire il palloncino sull’apertura superiore del contenitore;
- fate in modo che il bicarbonato si versi nell’aceto.
A questo punto la reazione sta avvendendo. Si notano delle bollicine ed il livello dell’aceto che sale. L’anidride carbonica sale verso l’alto gonfiando il palloncino.
Al termine della reazione l’aceto assume un colore giallognolo poichè si è trasformato in acetato di sodio. In questo stato esso non è più utilizzabile né in cucina né per altri esperimenti.
Facile no? Mi raccomnado fate il tutto sempre con la presenza di un adulto che supervisioni l’esecuzione delll’esperimento.
Fonti per l’approfondimento:
- Reazione chimica. (6 marzo 2017). Wikipedia, L’enciclopedia libera. Tratto il 18 marzo 2017, 16:46 da //it.wikipedia.org/w/index.php?title=Reazione_chimica&oldid=86335517.
- Antoine-Laurent de Lavoisier. (21 febbraio 2017). Wikipedia, L’enciclopedia libera. Tratto il 18 marzo 2017, 16:49 da //it.wikipedia.org/w/index.php?title=Antoine-Laurent_de_Lavoisier&oldid=86075849.
- Portale Chimica. //it.wikipedia.org/wiki/Portale:Chimica.
Video (esperimento)
Gallery
(Before / After)
(Altro)
- Reazione tra aceto e bicarbonato di socio
- Aceto
- Bicarbonato di sodio
- Aceto (acido acetico): formula
- Bicarbonato di sodio: formula
- Anidride carbonica: formula
- Acetato di sodio: formula
- Reazioni chimiche: i reagenti – Prima
- Reazioni chimiche: i prodotti – Dopo
- Reazioni chimiche – Prima/Dopo














 (+1 voti, 1 votanti)
(+1 voti, 1 votanti)